BROM
HALOGENE ELEMENT
| Ordnungszahl: | 35 |
| Elementgruppen: | 17 |
| Perioden: | 4 |
| Elektronenkonfiguration: | [Ar] 3d10 4s2 4p5 |
| Oxidationszustände: | -1 +1 +5 |
| Elekronegativität: | 2.96 |
| Atomradius / pm: | 114.5 |
| Relative atommasse: | [79.901, 79.907] |
Endeckung:1826 Antoine-Jérôme Balard (FR)
Der Name Brom kommt vom von griechischem bromos (Gestank), da es übel riecht. Brom ist bei Zimmertemperatur eine rotbraune, relativ schwere Flüssigkeit. Bromatome kommen in der Natur nur chemisch gebunden in Form der Bromide vor. Die Herstellung von Brom erfolgt in Deutschland aus bromidhaltigen Laugen, die bei der Salz- und Düngemittelherstellung aus dem Abraumsalz Kaliumchlorid anfallen. Elementares Brom dient wie Chlor als Oxidationsmittel und zum Bleichen in der Textil- und Papierindustrie, gelegentlich auch als Desinfektionsmittel in Schwimmbädern.
| Dichte / g dm-3: | 4050 | (123 K) |
| 3122.6 | (293 K) | |
| 7.59 | (gasförmig, 273 K) | |
| Atomvolumen / cm3mol-1: | 19.73 | (123 K) |
| 25.59 | (293 K) | |
| 21055.07 | (gasförmig, 273 K) | |
| Elektrische widerstandskraft / µΩcm: | - | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 0.0047 |
| Schmelzpunkt / °C: | -7.2 |
| Siedepunkt / °C: | 58.78 |
| Bildungsenergie / kJ mol-1: | 10.8 |
| Verdampfungsenergie / kJ mol-1: | 30.5 |
| Zerstäubungsenergie / kJ mol-1: | 117.943 |
| Erste ionisierungenergie / kJ mol-1: | 1139.87 |
| Zweite ionisierungenergie / kJ mol-1: | 2103.40 |
| Dritte ionisierungenergie / kJ mol-1: | 3473.50 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 2.5 |
| in den Ozeanen / ppm: | 65 |
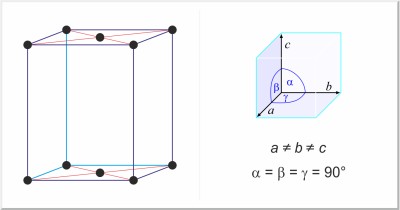
| Kristallstruktur: | orthorhombisch-basiszentriert |
| Gitterparameter der Elementarzelle / pm: | a=673.7, b=454.8, c=876.1 |
| Raumgruppe: | Cmca |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 79Br | 78.918338(2) | 50.69(7) |
| 81Br | 80.916291(3) | 49.31(7) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Br2(l) + 2e- → 2Br- | +1.065 | |
| Br2(aq) + 2e- → 2Br- | +1.087 | |
| Br3- + 2e- → 3Br- | +1.05 | |
| HBrO3 + 5H+ + 6e- → Br- + 3H2O | +1.42 | |
| 3HBrO3 + 15H+ + 16e- → Br3- + 9H2O | +1.462 | |
| 2BrO3- + 12H+ + 10e- → Br2(l) + 6H2O | +1.52 | |
| BrO3- + 6H+ + 6e- → Br- + 3H2O | +1.44 | |
| BrO3- + 3H2O + 6e- → Br- + 6OH- | +0.61 | |
| 2HBrO2 + 10H+ + 10e- → Br2(l) + 6H2O | +1.48 | |
| HBrO3 + 4H+ + 4e- → HBrO + 2H2O | +1.46 | |
| HBrO3 + 3H+ + 4e- → BrO- + 2H2O | +1.33 | |
| 2HBrO + 2H+ + 2e- → Br2(l) + 2H2O | +1.59 | |
| 2BrO- + 4H+ + 2e- → Br2(l) + 2H2O | +2.09 | |
| 2BrO- + 2H2O + 2e- → Br2(l) + 4OH- | +0.45 | |
| BrO- + H2O + 2e- → Br- + 2OH- | +0.76 |
| 34 Selen | ← | 35 Brom | → | 36 Krypton |
Zitieren dieser Seite:
Generalic, Eni. "Brom." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. {Datum des Abrufs}. <https://www.periodni.com/de/br.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
