TELURIJ
HALKOGENI ELEMENT
| Atomski broj: | 52 |
| Skupina: | 16 |
| Perioda: | 5 |
| Elektronska konfiguracija: | [Kr] 4d10 5s2 5p4 |
| Oksidacijski broj: | -2 +4 +6 |
| Elektronegativnost: | 2.1 |
| Atomski radijus / pm: | 143.2 |
| Relativna atomska masa: | 127.60(3) |
Telurij je 1782. godine otkrio Franz Joseph Muller von Reichstein (AT). Ime je dobio od latinske riječi tellus što znači zemlja. To je srebrno bijela krutina metalnog izgleda ili tamno sivi prah nepodnošljivog mirisa koji se upije u kožu. Ne reagira s vodom i kloridnom kiselinom ali je topljiv u nitratnoj kiselini. Gori na zraku. Telurij je otrovan ako se unese u organizam. Telurij dolazi uz sulfide bakra i olova pa se i dobiva kao sporedni proizvod pri dobivanju ovih metala. Upotrebljava se za legiranje, aditiv u gumi, katalizator u kemijskoj industriji i za proizvodnju lampi s "dnevnim" svjetlom. Cijena telurija u obliku lomljenih ingota čistoće 99.99% iznosi 175.90 € za 250 g.
| Gustoća / g dm-3: | 6240 | (293 K) |
| 5797 | (t.t.) | |
| Molarni volumen / cm3mol-1: | 20.45 | (293 K) |
| 22.01 | (t.t.) | |
| Električna otpornost / µΩcm: | 436000 | (20 °C) |
| Toplinska vodljivost / W m-1K-1: | 2.35 |
| Temperatura taljenja / °C: | 449.51 |
| Temperatura vrenja / °C: | 988 |
| Toplina taljenja / kJ mol-1: | 13.5 |
| Toplina isparavanja / kJ mol-1: | 104.6 |
| Toplina atomiziranja / kJ mol-1: | - |
| Prva energija ionizacije / kJ mol-1: | 869.30 |
| Druga energija ionizacije / kJ mol-1: | 1794.64 |
| Treća energija ionizacije / kJ mol-1: | 2697.75 |
| u atmosferi / ppm: | - |
| u Zemljinoj kori / ppm: | 0.01 |
| u oceanima / ppm: | - |
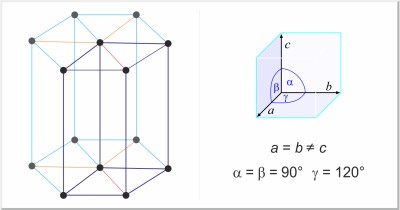
| Kristalna struktura: | heksagonska |
| Dimenzije jedinične ćelije / pm: | a=445.65, c=592.68 |
| Prostorna grupa: | P3121 |
| Izotop | Relativna atomska masa | Maseni udio (%) |
|---|---|---|
| 120Te | 119.90402(1) | 0.096(2) |
| 122Te | 121.903047(2) | 2.603(4) |
| 123Te | 122.904273(2) | 0.908(2) |
| 124Te | 123.902819(2) | 4.816(6) |
| 125Te | 124.904425(2) | 7.139(6) |
| 126Te | 125.903306(2) | 18.95(1) |
| 128Te | 127.904461(2) | 31.69(1) |
| 130Te | 129.906223(2) | 33.80(1) |
| Uravnotežena polureakcija | Eo / V | |
|---|---|---|
| Te4+ + 4e- → Te(s) | +0.568 | |
| Te4+ + 2H+ + 6e- → H2Te(g) | +0.132 | |
| TeO42- + 4H+ + 2e- → TeO2(s) + 2H2O | +1.509 | |
| HTeO4- + 3H+ + 2e- → TeO2(s) + 2H2O | +1.202 | |
| H2TeO4 + 2H+ + 2e- → TeO2(s) + 2H2O | +1.020 | |
| TeO42- + 2H+ + 2e- → TeO32- + H2O | +0.892 | |
| HTeO4- + H+ + 2e- → TeO32- + H2O | +0.584 | |
| HTeO4- + 2H+ + 2e- → HTeO3- + H2O | +0.813 | |
| H2TeO4 + H+ + 2e- → HTeO3- + H2O | +0.631 | |
| H2TeO4 + 3H+ + 2e- → HTeO2+ + 2H2O | +0.953 | |
| H2TeO4 + 6H+ + 2e- → Te4+ + 4H2O | +0.920 | |
| Te(OH)6(s) + 2H+ + 2e- → TeO2(s) + 4H2O | +1.02 | |
| TeO32- + 6H+ + 4e- → Te(s) + 3H2O | +0.827 | |
| HTeO3- + 5H+ + 4e- → Te(s) + 3H2O | +0.713 | |
| HTeO2+ + 3H+ + 4e- → Te(s) + 2H2O | +0.551 | |
| TeO2+ + 5H+ + 6e- → H2Te(g) + 2H2O | +0.121 | |
| Te(s) + 2H+ + 2e- → H2Te(g) | - 0.739 | |
| Te(s) + 2e- → Te2- | - 1.14 |
| 51 Antimon | ← | 52 Telurij | → | 53 Jod |
Citiranje ove stranice:
Generalić, Eni. "Telurij." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. {Datum pristupa}. <https://www.periodni.com/hr/te.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
