JOD
HALOGENI ELEMENT
| Atomski broj: | 53 |
| Skupina: | 17 |
| Perioda: | 5 |
| Elektronska konfiguracija: | [Kr] 4d10 5s2 5p5 |
| Oksidacijski broj: | -1 +1 +5 +7 |
| Elektronegativnost: | 2.66 |
| Atomski radijus / pm: | 133.1 |
| Relativna atomska masa: | 126.904 47(3) |
Jod je 1811. godine otkrio Bernard Courtois (FR). Ime mu dolazi od grčke riječi ioeides za ljubičastu boju zbog karakteristične boje njegovih para. To je sjajna, ljubičasto-crna krutina karakterističnog mirisa koja lako sublimira. Jod se slabo otapa u vodi, ali se dobro otapa u alkoholu. Pare joda su otrovne. Jod izaziva opekline na koži. Jod se u prirodi nalazi u obliku jodida i jodata. Dobiva se iz čilske salitre ili iz pepela morskih algi. Upotrebljava se u organskoj sintezi, dezinfekciju i kao preventivno sredstvo protiv gušavosti (dodatak prehrani). Cijena kristalnog joda čistoće 99.5% iznosi 140.50 € za 1000 g.
| Gustoća / g dm-3: | 4930 | (293 K) |
| Molarni volumen / cm3mol-1: | 25.74 | (293 K) |
| Električna otpornost / µΩcm: | 1.3E+15 | (20 °C) |
| Toplinska vodljivost / W m-1K-1: | 0.449 |
| Temperatura taljenja / °C: | 113.7 |
| Temperatura vrenja / °C: | 184.4 |
| Toplina taljenja / kJ mol-1: | 15.27 |
| Toplina isparavanja / kJ mol-1: | 41.67 |
| Toplina atomiziranja / kJ mol-1: | 107.24 |
| Prva energija ionizacije / kJ mol-1: | 1008.40 |
| Druga energija ionizacije / kJ mol-1: | 1845.90 |
| Treća energija ionizacije / kJ mol-1: | 3184.04 |
| u atmosferi / ppm: | - |
| u Zemljinoj kori / ppm: | 0.5 |
| u oceanima / ppm: | 0.05 |
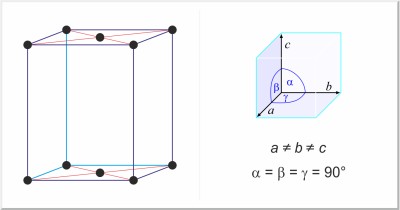
| Kristalna struktura: | bazno centrirana ortorompska |
| Dimenzije jedinične ćelije / pm: | a=726.47, b=478.57, c=979.08 |
| Prostorna grupa: | Cmca |
| Izotop | Relativna atomska masa | Maseni udio (%) |
|---|---|---|
| 127I | 126.904468(4) | 100 |
| Uravnotežena polureakcija | Eo / V | |
|---|---|---|
| I2(s) + 2e- → 2I- | +0.535 | |
| I2(aq) + 2e- → 2I- | +0.615 | |
| 3I2 + 2e- → 2I3- | +0.789 | |
| I3- + 2e- → 3I- | +0.536 | |
| H5IO6 + H+ + 2e- → IO3- + 3H2O | +1.601 | |
| HIO52- + 3H+ + 2e- → IO3- + 2H2O | +1.898 | |
| HIO52- + 8H+ + 6e- → HIO + 4H2O | +1.389 | |
| 2HIO52- + 18H+ + 14e- → I2(s) + 10H2O | +1.384 | |
| 3HIO52- + 27H+ + 22e- → I3- + 15H2O | +1.357 | |
| HIO52- + 9H+ + 8e- → I- + 5H2O | +1.288 | |
| HIO4 + 2H+ + 2e- → HIO3 + H2O | +1.626 | |
| IO4- + 2H+ + 2e- → IO3- + H2O | +1.653 | |
| HIO4 + 6H+ + 6e- → HIO + 3H2O | +1.290 | |
| IO4- + 7H+ + 6e- → HIO + 3H2O | +1.235 | |
| 2HIO4 + 14H+ + 14e- → I2(s) + 8H2O | +1.300 | |
| 3HIO4 + 21H+ + 22e- → I3- + 12H2O | +1.276 | |
| HIO4 + 7H+ + 8e- → I- + 4H2O | +1.215 | |
| IO3- + 6H+ + 4e- → I+ + 3H2O | +1.155 | |
| IO3- + 4H+ + 4e- → IO- + 2H2O | +0.972 | |
| 2IO3- + 12H+ + 10e- → I2(s) + 6H2O | +1.196 | |
| 2IO3- + 12H+ + 10e- → I2(aq) + 6H2O | +1.178 | |
| IO3- + 2Cl- + 6H+ + 4e- → ICl2- + 3H2O | +1.24 | |
| 2HIO3 + 10H+ + 10e- → I2(s) + 6H2O | +1.169 | |
| 3HIO3 + 15H+ + 16e- → I3- + 9H2O | +1.145 | |
| HIO3 + 5H+ + 6e- → I- + 3H2O | +1.078 | |
| 2HIO + 2H+ + 2e- → I2(s) + 2H2O | +1.354 | |
| 2IO- + 4H+ + 2e- → I2(s) + 2H2O | +2.005 | |
| 3HIO + 3H+ + 4e- → I3- + 3H2O | +1.213 | |
| 3IO- + 6H+ + 4e- → I3- + 3H2O | +1.701 | |
| IO- + 2H+ + 2e- → I- + H2O | +1.313 | |
| HIO + H+ + 2e- → I- + H2O | +0.987 | |
| 2ICl3(s) + 6e- → I2(s) + 6Cl- | +1.28 | |
| 2ICl(s) + 2e- → I2(s) + 2Cl- | +1.22 | |
| 2ICl + 2e- → I2(s) + 2Cl- | +1.19 | |
| 2ICl2- + 2e- → I2(s) + 4Cl- | +1.056 | |
| 2IBr(aq) + 2e- → I2(s) + 2Br- | +1.02 |
| 52 Telurij | ← | 53 Jod | → | 54 Ksenon |
Citiranje ove stranice:
Generalić, Eni. "Jod." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. {Datum pristupa}. <https://www.periodni.com/hr/i.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
