MERCURIO
ELEMENTOS DE TRANSICIÓN: GRUPO DEL ZINC
| Número atómico: | 80 |
| Grupo: | 12 |
| Periodo: | 6 |
| Configuración electrónica: | [Xe] 4f14 5d10 6s2 |
| Estados de oxidación: | +1 +2 |
| Electronegatividad: | 1.9 |
| Radio atómico / pm: | 150.3 |
| Masa atómica relativa: | 200.592(3) |
El mercurio se conoce desde la antigüedad. El símbolo Hg procede del latín hydrargyrum, que significa 'plata líquida'. Ya los antiguos griegos y romanos obtuvieron mercurio, el único metal líquido a temperatura ambiente, a partir de cinabrio (sulfuro de mercurio). A temperaturas ordinarias el mercurio es un líquido brillante , muy denso, de color blanco platedo. Ligeramente volátil a temperatura ambiente produciendo vapores muy tóxicos. Se emplea en termómetros, barómetros, pesticidas, pinturas antisuciedad, baterías, bombas de vacío y como catalizador. Se utilizaba en amalgamas dentales, pero esa práctica está cayendo en desuso. Sus aplicaciones eléctricas comprenden la fabricación de lámparas de vapor de mercurio y anuncios luminosos, interruptores eléctricos y otros dispositivos electrónicos.
| Densidad / g dm-3: | 13546 | (293 K) |
| Volumen molar / cm3mol-1: | 14.81 | (293 K) |
| Resistencia eléctrica / µΩcm: | 95.8 | (20 °C) |
| Conductividad térmica / W m-1K-1: | 8.34 |
| Punto de fusión / °C: | -38.83 |
| Punto de ebullición / °C: | 356.73 |
| Calor de fusión / kJ mol-1: | 2.331 |
| Calor de vaporización / kJ mol-1: | 59.11 |
| Calor de atomización / kJ mol-1: | 64.463 |
| Primera energía de ionización / kJ mol-1: | 1007.07 |
| Segunda energía de ionización / kJ mol-1: | 1809.69 |
| Tercera energía de ionización / kJ mol-1: | 3299.82 |
| en la atmósfera / ppm: | - |
| en la corteza terrestre / ppm: | 0.08 |
| en los océanos / ppm: | 0.00003 |
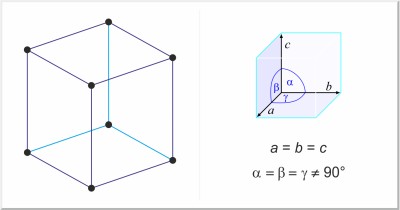
| Estructura cristalina: | romboédrica |
| Dimensiones de la celda unidad / pm: | a=299.25, α=70°44.6' |
| Grupo espacial: | R3m |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 196Hg | 195.965815(4) | 0.15(1) |
| 198Hg | 197.966752(3) | 9.97(8) |
| 199Hg | 198.968262(3) | 16.87(10) |
| 200Hg | 199.968309(3) | 23.10(16) |
| 201Hg | 200.970285(3) | 13.18(8) |
| 202Hg | 201.970626(3) | 29.86(20) |
| 204Hg | 203.973476(3) | 6.87(4) |
| Semirreacción | Eo / V | |
|---|---|---|
| Hg2+ + 2e- → Hg(l) | +0.854 | |
| 2Hg2+ + 2e- → Hg22+ | +0.920 | |
| 2Hg2+ + 2e- → Hg22+ | +0.907 | (1 mol dm-3 HClO4) |
| Hg22+ + 2e- → 2Hg(l) | +0.788 | |
| Hg22+ + 2e- → 2Hg(l) | +0.274 | (1 mol dm-3 HCl) |
| Hg22+ + 2e- → 2Hg(l) | +0.776 | (1 mol dm-3 HClO4) |
| Hg22+ + 2e- → 2Hg(l) | +0.674 | (1 mol dm-3 H2SO4) |
| HgO(s) + H2O + 2e- → Hg(l) + 2OH- | +0.10 | |
| HgO(s) + 2H+ + 2e- → Hg(l) + H2O | +0.93 | |
| 2Hg(OH)2(s) + 4H+ + 2e- → Hg22+ + 4H2O | +1.28 | |
| Hg2Cl2(s) + 2e- → 2Hg(l) + 2Cl- | +0.268 | |
| Hg2Cl2(s) + 2e- → 2Hg(l) + 2Cl- | +0.244 | (saturated KCl) |
| Hg2Cl2(s) + 2e- → 2Hg(l) + 2Cl- | +0.282 | (1 mol dm-3 KCl) |
| Hg2Cl2(s) + 2e- → 2Hg(l) + 2Cl- | +0.334 | (0.1 mol dm-3 KCl) |
| Hg2Br2(s) + 2e- → 2Hg(l) + 2Br- | +0.14 | |
| Hg2I2(s) + 2e- → 2Hg(l) + 2I- | - 0.04 | |
| Hg2C2O4(s) + 2e- → 2Hg(l) + C2O42- | +0.42 | |
| Hg2SO4(s) + 2e- → 2Hg(l) + SO42- | +0.615 | |
| HgS(s) (negro) + 2e- → Hg(l) + S2- | - 0.67 | |
| HgS(s) (rojo) + 2e- → Hg + S2- | - 0.70 | |
| Hg(CN)42- + 2e- → Hg(l) + 4CN- | - 0.37 |
Citación de esta página:
Generalic, Eni. "Mercurio." EniG. Tabla periódica de los elementos. KTF-Split, 13 Feb. 2025. Web. {Fecha de acceso}. <https://www.periodni.com/es/hg.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
