PLATA
ELEMENTOS DE TRANSICIÓN: GRUPO DEL COBRE
| Número atómico: | 47 |
| Grupo: | 11 |
| Periodo: | 5 |
| Configuración electrónica: | [Kr] 4d10 5s1 |
| Estados de oxidación: | +1 |
| Electronegatividad: | 1.93 |
| Radio atómico / pm: | 144.5 |
| Masa atómica relativa: | 107.8682(2) |
La plata se conoce y valora como metal decorativo y para monedas desde tiempos muy remotos gracias a su belleza y facilidad de manipulación. La plata tomó nombre del adjetivo plattus, del latín medieval, ancho, aplanado. Se utilizó para nombrar específicamente los lingotes del metal que los romanos habían llamado argentum (por eso el símbolo Ag). La plata pura es de color blanco, muy blanda y dúctil. Es el metal que mejor conduce el calor y la electricidad. En fotografía se aprovecha la sensibilidad a la luz del bromuro de plata.
| Densidad / g dm-3: | 10500 | (293 K) |
| 9345 | (m.p.) | |
| Volumen molar / cm3mol-1: | 10.27 | (293 K) |
| 11.54 | (m.p.) | |
| Resistencia eléctrica / µΩcm: | 1.59 | (20 °C) |
| Conductividad térmica / W m-1K-1: | 429 |
| Punto de fusión / °C: | 961.78 |
| Punto de ebullición / °C: | 2162 |
| Calor de fusión / kJ mol-1: | 11.3 |
| Calor de vaporización / kJ mol-1: | 257.7 |
| Calor de atomización / kJ mol-1: | 284.09 |
| Primera energía de ionización / kJ mol-1: | 731.01 |
| Segunda energía de ionización / kJ mol-1: | 2073.48 |
| Tercera energía de ionización / kJ mol-1: | 3360.61 |
| en la atmósfera / ppm: | - |
| en la corteza terrestre / ppm: | 0.08 |
| en los océanos / ppm: | 0.0003 |
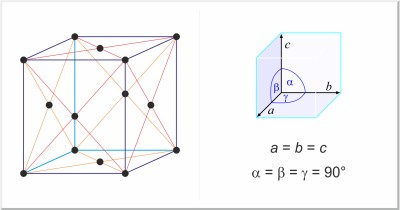
| Estructura cristalina: | cúbica centrada en las caras |
| Dimensiones de la celda unidad / pm: | a=408.626 |
| Grupo espacial: | Fm3m |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 107Ag | 106.905093(6) | 51.839(7) |
| 109Ag | 108.904756(3) | 48.161(7) |
| Semirreacción | Eo / V | |
|---|---|---|
| Ag+ + e- → Ag(s) | +0.799 | |
| Ag+ + e- → Ag(s) | +0.228 | (1 mol dm-3 HCl) |
| Ag+ + e- → Ag(s) | +0.792 | (1 mol dm-3 HClO4) |
| Ag+ + e- → Ag(s) | +0.77 | (1 mol dm-3 H2SO4) |
| Ag2+ + e- → Ag+ | +1.998 | |
| AgO+ + 2H+ + e- → Ag2+ + H2O | +2.016 | |
| 2AgO(s) + 2H+ + 2e- → Ag2O + H2O | +1.41 | |
| 2AgO(s) + H2O + 2e- → Ag2O + OH- | +0.599 | |
| Ag2O(s) + 2H+ + 2e- → 2Ag(s) + H2O | +1.173 | |
| Ag2O(s) + H2O + 2e- → 2Ag(s) + 2OH- | +0.342 | |
| Ag2CrO4(s) + 2e- → 2Ag(s) + CrO42- | +0.446 | |
| Ag2S(s) + 2H+ + 2e- → 2Ag(s) + H2S(g) | - 0.036 | |
| Ag2S(s) + 2e- → 2Ag(s) + S2- | - 0.712 | |
| AgCl(s) + e- → Ag(s) + Cl- | +0.222 | |
| AgCl(s) + e- → Ag(s) + Cl- | +0.228 | (1 mol dm-3 KCl) |
| AgBr(s) + e- → Ag(s) + Br- | +0.073 | |
| AgI(s) + e- → Ag(s) + I- | - 0.151 | |
| Ag(CN)2- + e- → Ag(s) + 2CN- | - 0.31 | |
| Ag(S2O3)23- + e- → Ag(s) + 2S2O32- | +0.017 |
| 46 Paladio | ← | 47 Plata | → | 48 Cadmio |
Citación de esta página:
Generalic, Eni. "Plata." EniG. Tabla periódica de los elementos. KTF-Split, 8 Feb. 2026. Web. {Fecha de acceso}. <https://www.periodni.com/es/ag.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
