YODO
HALÓGENOS
| Número atómico: | 53 |
| Grupo: | 17 |
| Periodo: | 5 |
| Configuración electrónica: | [Kr] 4d10 5s2 5p5 |
| Estados de oxidación: | -1 +1 +5 +7 |
| Electronegatividad: | 2.66 |
| Radio atómico / pm: | 133.1 |
| Masa atómica relativa: | 126.904 47(3) |
El yodo fue descubierto en 1811 por Bernard Courtois un fabricante francés de nitro. Su nombre proviene de la palabra griega 'iodes', que significa violado, debido a la coloración de sus vapores. Es un sólido cristalino a temperatura ambiente, de color negro azulado y brillante, que sublima dando un vapor violeta muy denso. Soluciones de yodo y alcohol y complejos de yodo se utilizan como antisépticos y desinfectantes. Isótopos radiactivos del yodo se usan en medicina nuclear como trazadores. El yodo es un elemento esencial, que se acumula en el tiroides.
| Densidad / g dm-3: | 4930 | (293 K) |
| Volumen molar / cm3mol-1: | 25.74 | (293 K) |
| Resistencia eléctrica / µΩcm: | 1.3E+15 | (20 °C) |
| Conductividad térmica / W m-1K-1: | 0.449 |
| Punto de fusión / °C: | 113.7 |
| Punto de ebullición / °C: | 184.4 |
| Calor de fusión / kJ mol-1: | 15.27 |
| Calor de vaporización / kJ mol-1: | 41.67 |
| Calor de atomización / kJ mol-1: | 107.24 |
| Primera energía de ionización / kJ mol-1: | 1008.40 |
| Segunda energía de ionización / kJ mol-1: | 1845.90 |
| Tercera energía de ionización / kJ mol-1: | 3184.04 |
| en la atmósfera / ppm: | - |
| en la corteza terrestre / ppm: | 0.5 |
| en los océanos / ppm: | 0.05 |
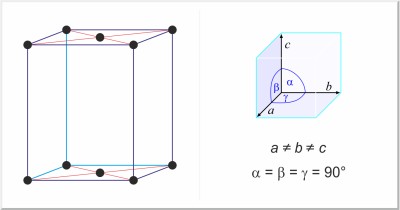
| Estructura cristalina: | ortorrómbica centrada en las bases |
| Dimensiones de la celda unidad / pm: | a=726.47, b=478.57, c=979.08 |
| Grupo espacial: | Cmca |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 127I | 126.904468(4) | 100 |
| Semirreacción | Eo / V | |
|---|---|---|
| I2(s) + 2e- → 2I- | +0.535 | |
| I2(aq) + 2e- → 2I- | +0.615 | |
| 3I2 + 2e- → 2I3- | +0.789 | |
| I3- + 2e- → 3I- | +0.536 | |
| H5IO6 + H+ + 2e- → IO3- + 3H2O | +1.601 | |
| HIO52- + 3H+ + 2e- → IO3- + 2H2O | +1.898 | |
| HIO52- + 8H+ + 6e- → HIO + 4H2O | +1.389 | |
| 2HIO52- + 18H+ + 14e- → I2(s) + 10H2O | +1.384 | |
| 3HIO52- + 27H+ + 22e- → I3- + 15H2O | +1.357 | |
| HIO52- + 9H+ + 8e- → I- + 5H2O | +1.288 | |
| HIO4 + 2H+ + 2e- → HIO3 + H2O | +1.626 | |
| IO4- + 2H+ + 2e- → IO3- + H2O | +1.653 | |
| HIO4 + 6H+ + 6e- → HIO + 3H2O | +1.290 | |
| IO4- + 7H+ + 6e- → HIO + 3H2O | +1.235 | |
| 2HIO4 + 14H+ + 14e- → I2(s) + 8H2O | +1.300 | |
| 3HIO4 + 21H+ + 22e- → I3- + 12H2O | +1.276 | |
| HIO4 + 7H+ + 8e- → I- + 4H2O | +1.215 | |
| IO3- + 6H+ + 4e- → I+ + 3H2O | +1.155 | |
| IO3- + 4H+ + 4e- → IO- + 2H2O | +0.972 | |
| 2IO3- + 12H+ + 10e- → I2(s) + 6H2O | +1.196 | |
| 2IO3- + 12H+ + 10e- → I2(aq) + 6H2O | +1.178 | |
| IO3- + 2Cl- + 6H+ + 4e- → ICl2- + 3H2O | +1.24 | |
| 2HIO3 + 10H+ + 10e- → I2(s) + 6H2O | +1.169 | |
| 3HIO3 + 15H+ + 16e- → I3- + 9H2O | +1.145 | |
| HIO3 + 5H+ + 6e- → I- + 3H2O | +1.078 | |
| 2HIO + 2H+ + 2e- → I2(s) + 2H2O | +1.354 | |
| 2IO- + 4H+ + 2e- → I2(s) + 2H2O | +2.005 | |
| 3HIO + 3H+ + 4e- → I3- + 3H2O | +1.213 | |
| 3IO- + 6H+ + 4e- → I3- + 3H2O | +1.701 | |
| IO- + 2H+ + 2e- → I- + H2O | +1.313 | |
| HIO + H+ + 2e- → I- + H2O | +0.987 | |
| 2ICl3(s) + 6e- → I2(s) + 6Cl- | +1.28 | |
| 2ICl(s) + 2e- → I2(s) + 2Cl- | +1.22 | |
| 2ICl + 2e- → I2(s) + 2Cl- | +1.19 | |
| 2ICl2- + 2e- → I2(s) + 4Cl- | +1.056 | |
| 2IBr(aq) + 2e- → I2(s) + 2Br- | +1.02 |
| 52 telurio | ← | 53 Yodo | → | 54 Xenón |
Citación de esta página:
Generalic, Eni. "Yodo." EniG. Tabla periódica de los elementos. KTF-Split, 8 Feb. 2026. Web. {Fecha de acceso}. <https://www.periodni.com/es/i.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
