PLOMO
GRUPO DEL CARBONO
| Número atómico: | 82 |
| Grupo: | 14 |
| Periodo: | 6 |
| Configuración electrónica: | [Xe] 4f14 5d10 6s2 6p2 |
| Estados de oxidación: | +2 +4 |
| Electronegatividad: | 1.8 |
| Radio atómico / pm: | 175 |
| Masa atómica relativa: | 207.2(1) |
El plomo se conoce su existencia desde tiempos remotos. Las tuberías de plomo que conducían a los antiguos baños romanos eran utilizables hasta nuestros días. El plomo viene del latín 'plumbum'. Es un metal brillante color blanco azulado, muy suave, altamente maleable y dúctil. Al contacto con el aire forma rápidamente una capa protectora de color gris de carbonato básico que impide la posterior corrosión. Se emplea en baterías, municiones, recubrimiento de cables, fontanería y recipientes para líquidos corrosivos. También se utiliza en protecciones contra la radiación en reactores nucleares y en quipos de rayos X.
| Densidad / g dm-3: | 11350 | (293 K) |
| 10678 | (m.p.) | |
| Volumen molar / cm3mol-1: | 18.26 | (293 K) |
| 19.40 | (m.p.) | |
| Resistencia eléctrica / µΩcm: | 20.648 | (20 °C) |
| Conductividad térmica / W m-1K-1: | 35.3 |
| Punto de fusión / °C: | 327.46 |
| Punto de ebullición / °C: | 1749 |
| Calor de fusión / kJ mol-1: | 5.121 |
| Calor de vaporización / kJ mol-1: | 177.8 |
| Calor de atomización / kJ mol-1: | 195.74 |
| Primera energía de ionización / kJ mol-1: | 715.60 |
| Segunda energía de ionización / kJ mol-1: | 1450.40 |
| Tercera energía de ionización / kJ mol-1: | 3081.50 |
| en la atmósfera / ppm: | - |
| en la corteza terrestre / ppm: | 8 |
| en los océanos / ppm: | 0.003 |
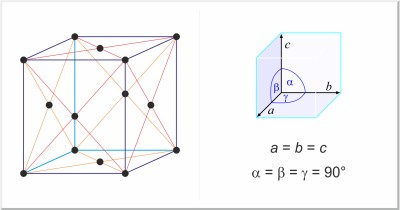
| Estructura cristalina: | cúbica centrada en las caras |
| Dimensiones de la celda unidad / pm: | a=495.00 |
| Grupo espacial: | Fm3m |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 204Pb | 203.973029(3) | 1.4(1) |
| 206Pb | 205.974449(3) | 24.1(1) |
| 207Pb | 206.975881(3) | 22.1(1) |
| 208Pb | 207.976636(3) | 52.4(1) |
| Semirreacción | Eo / V | |
|---|---|---|
| Pb4+ + 2e- → Pb2+ | +1.694 | |
| Pb2+ + 2e- → Pb(s) | - 0.126 | |
| Pb2+ + 2e- → Pb(s) | - 0.14 | (1 mol dm-3 HClO4) |
| Pb2+ + 2e- → Pb(s) | - 0.29 | (1 mol dm-3 H2SO4) |
| 3PbO2(s) + 2H2O + 4e- → Pb3O4(s) + 4OH- | +0.295 | |
| PbO2(s) + 4H+ + 2e- → Pb2+ + 2H2O | +1.455 | |
| PbO2(s) + 4H+ + SO42- + 2e- → PbSO4(s) + 2H2O | +1.685 | |
| PbO2(s) + H+ + 2e- → HPbO2- | +0.621 | |
| 3PbO32- + 10H+ + 4e- → Pb3O4(s) + 5H2O | +2.515 | |
| PbO32- + 4H+ + 2e- → PbO(s) + 2H2O | +2.001 | |
| PbO32- + 3H+ + e- → HPbO2- + H2O | +1.547 | |
| PbO32- + 6H+ + 2e- → Pb2+ + 3H2O | +2.375 | |
| Pb3O4(s) + H2O + 2e- → 3PbO(s) + 2OH- | +0.249 | |
| Pb3O4(s) + 8H+ + 2e- → 3Pb2+ + 3H2O | +2.094 | |
| Pb3O4(s) + 2H2O + 2e- → 3HPbO2- + H+ | - 0.390 | |
| PbO(s) + 2H+ + 2e- → Pb(s) + H2O | +0.249 | |
| PbSO4 + 2e- → Pb(s) + SO42- | - 0.350 | |
| HPbO2- + 3H+ + 2e- → Pb(s) + 2H2O | +0.702 | |
| Pb(s) + 2H+ + 2e- → PbH2 | - 1.507 |
| 81 Talio | ← | 82 Plomo | → | 83 Bismuto |
Citación de esta página:
Generalic, Eni. "Plomo." EniG. Tabla periódica de los elementos. KTF-Split, 13 Feb. 2025. Web. {Fecha de acceso}. <https://www.periodni.com/es/pb.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
