TITANIO
ELEMENTOS DE TRANSICIÓN: GRUPO DEL TITANIO
| Número atómico: | 22 |
| Grupo: | 4 |
| Periodo: | 4 |
| Configuración electrónica: | [Ar] 3d2 4s2 |
| Estados de oxidación: | +2 +3 +4 |
| Electronegatividad: | 1.54 |
| Radio atómico / pm: | 144.8 |
| Masa atómica relativa: | 47.867(1) |
Su existencia fue descubierta en 1791 por el clérigo inglés W. Gregor (1761-1817). Cuatro años después, el químico alemán Martin Heinrich Klaproth volvió a descubrir el elemento en el mineral rutilo, y le llamó titanio como alusión a la fuerza de los mitológicos titanes griegos. Es un elemento metálico blanco plateado que se usa principalmente para preparar aleaciones ligeras y fuertes. El titanio sólo es soluble en ácido fluorhídrico y en ácidos en caliente como el sulfúrico. Como metal mejora las características del acero y se emplea además por sus valiosas propiedades como material en la navegación aérea y espacial, y en la construcción de submarinos. El dióxido de titanio es un pigmento que cubre superficies de forma eficaz, se utiliza en pintura, caucho, papel y muchos otros productos.
| Densidad / g dm-3: | 4540 | (293 K) |
| 4110 | (m.p.) | |
| Volumen molar / cm3mol-1: | 10.54 | (293 K) |
| 11.65 | (m.p.) | |
| Resistencia eléctrica / µΩcm: | 42 | (20 °C) |
| Conductividad térmica / W m-1K-1: | 21.9 |
| Punto de fusión / °C: | 1668 |
| Punto de ebullición / °C: | 3287 |
| Calor de fusión / kJ mol-1: | 20.9 |
| Calor de vaporización / kJ mol-1: | 425.5 |
| Calor de atomización / kJ mol-1: | 467.14 |
| Primera energía de ionización / kJ mol-1: | 658.82 |
| Segunda energía de ionización / kJ mol-1: | 1309.85 |
| Tercera energía de ionización / kJ mol-1: | 2652.56 |
| en la atmósfera / ppm: | - |
| en la corteza terrestre / ppm: | 5400 |
| en los océanos / ppm: | 0.001 |
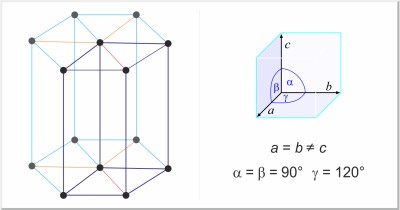
| Estructura cristalina: | hexagonal |
| Dimensiones de la celda unidad / pm: | a=295.11, c=468.43 |
| Grupo espacial: | P63/mmc |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 46Ti | 45.952629(1) | 8.0(1) |
| 47Ti | 46.951764(1) | 7.3(1) |
| 48Ti | 47.947947(1) | 73.8(1) |
| 49Ti | 48.947871(1) | 5.5(1) |
| 50Ti | 49.944792(1) | 5.4(1) |
| Semirreacción | Eo / V | |
|---|---|---|
| TiIV + e- → TiIII | - 0.092 | (1 mol dm-3 HCl) |
| TiIV + 4e- → Ti(s) | - 0.88 | (1 mol dm-3 HCl) |
| Ti3+ + e- → Ti2+ | - 0.369 | |
| Ti2+ + 2e- → Ti(s) | - 1.630 | |
| TiO22+ + H+ + 4e- → HTiO2- | +1.303 | |
| TiO22+ + 2H+ + 2e- → TiO2+ + H2O | +1.800 | |
| TiO2(s) + 4H+ + e- → Ti3+ + H2O | - 0.666 | |
| TiO2(s) + 4H+ + 2e- → Ti2+ + H2O | - 0.502 | |
| TiO2+ + 2H+ + e- → Ti3+ + H2O | +0.099 | |
| TiO2+ + 2H+ + e- → Ti3+ + H2O | +0.04 | (1 mol dm-3 H2SO4) |
| TiO2+ + 2H+ + 2e- → Ti2+ + H2O | - 0.135 | |
| HTiO2- + 5H+ + 2e- → Ti2+ + 3H2O | +0.362 | |
| TiF62- + 4e- → Ti(s) + 6F- | - 1.19 |
| 21 Escandio | ← | 22 Titanio | → | 23 Vanadio |
Citación de esta página:
Generalic, Eni. "Titanio." EniG. Tabla periódica de los elementos. KTF-Split, 13 Feb. 2025. Web. {Fecha de acceso}. <https://www.periodni.com/es/ti.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
