FOSFOR
DUŠIKOVA SKUPINA
| Atomski broj: | 15 |
| Skupina: | 15 |
| Perioda: | 3 |
| Elektronska konfiguracija: | [Ne] 3s2 3p3 |
| Oksidacijski broj: | -3 +3 +5 |
| Elektronegativnost: | 2.19 |
| Atomski radijus / pm: | 110.5 |
| Relativna atomska masa: | 30.973 761 998(5) |
Fosfor je 1669. godine otkrio Hennig Brandt (DE). Ime mu dolazi od grčke riječi phosphoros što znači donošenje (rađanje) svjetlosti. Fosfor se javlja u tri alotropske modifikacije. Bijeli fosfor je bijela do žuta mekana voštana krutina s nagrizajućim parama koja se ne otapa u vodi ali se otapa u mastima i uljima. Na zraku se sam od sebe zapali. Mekan je a u mraku svjetluca. Crveni fosfor je stabilan i netopljiv u svim otapalima. Crni fosfor je vrlo postojana krutina metalnog sjaja. Crveni fosfor nije otrovan, dok je bijeli vrlo otrovan. Udisanje njegovih para je, i u vrlo malim količinama, smrtonosno. U dodiru s kožom izaziva duboke opekline koje teško zarastaju. U prirodi se najčešće javlja u mineralima fosforitu (Ca3(PO4)2) i apatitu (3Ca3(PO4)2*Ca(ClF)2). Dobiva se iz fosforita prženjem s kvarcnim pijeskom i ugljenom u električnim pećima. Bijeli fosfor se upotrebljava kao otrov za štakore, a crveni u industriji šibica. Cijena fosfora u prahu čistoće 99% iznosi 43.90 € za 500 g.
| Gustoća / g dm-3: | 1820 | (bijeli, 293 K) |
| 2200 | (crveni, 293 K) | |
| 2690 | (crni, 293 K) | |
| Molarni volumen / cm3mol-1: | 17.02 | (bijeli, 293 K) |
| 14.08 | (crveni, 293 K) | |
| 11.51 | (crni, 293 K) | |
| Električna otpornost / µΩcm: | 1E+17 | (20 °C) |
| Toplinska vodljivost / W m-1K-1: | 0.235 |
| Temperatura taljenja / °C: | 44.15 |
| Temperatura vrenja / °C: | 280.5 |
| Toplina taljenja / kJ mol-1: | 2.51 |
| Toplina isparavanja / kJ mol-1: | 51.9 |
| Toplina atomiziranja / kJ mol-1: | 314 |
| Prva energija ionizacije / kJ mol-1: | 1011.82 |
| Druga energija ionizacije / kJ mol-1: | 1907.47 |
| Treća energija ionizacije / kJ mol-1: | 2914.14 |
| u atmosferi / ppm: | - |
| u Zemljinoj kori / ppm: | 1050 |
| u oceanima / ppm: | 0.07 |
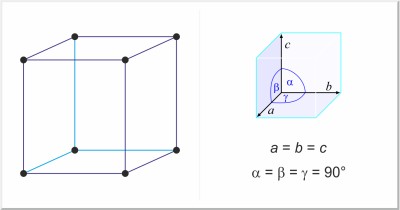
| Kristalna struktura: | jednostavna kubična |
| Dimenzije jedinične ćelije / pm: | a=1131 |
| Prostorna grupa: | Pm3m |
| Izotop | Relativna atomska masa | Maseni udio (%) |
|---|---|---|
| 31P | 30.9737615(2) | 100 |
| Uravnotežena polureakcija | Eo / V | |
|---|---|---|
| PO43- + 3H+ + 2e- → HPO32- + H2O | +0.121 | |
| HPO42- + 2H+ + 2e- → HPO32- + H2O | - 0.234 | |
| H2PO4- + H+ + 2e- → HPO32- + H2O | - 0.447 | |
| H2PO4- + 2H+ + 2e- → H2PO3- + H2O | - 0.260 | |
| H3PO4 + H+ + 2e- → H2PO3- + H2O | - 0.329 | |
| H3PO4 + 2H+ + 2e- → H3PO3 + H2O | - 0.276 | |
| PO43- + 8H+ + 5e- → P (crveni) + 4H2O | - 0.128 | |
| PO43- + 8H+ + 5e- → P (bijeli) + 4H2O | - 0.156 | |
| HPO42- + 7H+ + 5e- → P (crveni) + 4H2O | - 0.288 | |
| HPO42- + 7H+ + 5e- → P (bijeli) + 4H2O | - 0.316 | |
| H2PO4- + 6H+ + 5e- → P (crveni) + 4H2O | - 0.358 | |
| H2PO4- + 6H+ + 5e- → P (bijeli) + 4H2O | - 0.386 | |
| H3PO4 + 5H+ + 5e- → P (crveni) + 4H2O | - 0.383 | |
| H3PO4 + 5H+ + 5e- → P (bijeli) + 4H2O | - 0.411 | |
| PO43- + 11H+ + 8e- → PH3(g) + 4H2O | - 0.123 | |
| HPO42- + 10H+ + 8e- → PH3(g) + 4H2O | - 0.212 | |
| H2PO4- + 9H+ + 8e- → PH3(g) + 4H2O | - 0.265 | |
| H3PO4 + 8H+ + 8e- → PH3(g) + 4H2O | - 0.281 | |
| H3PO3 + 2H+ + 2e- → H3PO2 + H2O | - 0.499 | |
| HPO32- + 5H+ + 3e- → P (crveni) + 3H2O | - 0.298 | |
| HPO32- + 5H+ + 3e- → P (bijeli) + 3H2O | - 0.346 | |
| H2PO3- + 4H+ + 3e- → P (crveni) + 3H2O | - 0.419 | |
| H2PO3- + 4H+ + 3e- → P (bijeli) + 3H2O | - 0.467 | |
| H3PO3 + 3H+ + 3e- → P (crveni) + 3H2O | - 0.454 | |
| H3PO3 + 3H+ + 3e- → P (bijeli) + 3H2O | - 0.502 | |
| H4P2O6 + 2H+ + 2e- → 2H3PO3 | +0.38 | |
| 2H3PO4 + 2H+ + 2e- → H4P2O6 + 2H2O | - 0.94 | |
| P (crveni) + 3H+ + 3e- → PH3(g) | - 0.111 | |
| P (bijeli) + 3H+ + 3e- → PH3(g) | - 0.063 |
| 14 Silicij | ← | 15 Fosfor | → | 16 Sumpor |
Citiranje ove stranice:
Generalić, Eni. "Fosfor." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. {Datum pristupa}. <https://www.periodni.com/hr/p.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
