F
Fluor
FLÚOR
HALÓGENOS
| Número atómico: | 9 |
| Grupo: | 17 |
| Periodo: | 2 |
| Configuración electrónica: | [He] 2s2 2p5 |
| Estados de oxidación: | -1 |
| Electronegatividad: | 3.98 |
| Radio atómico / pm: | 70.9 |
| Masa atómica relativa: | 18.998 403 163(6) |
En estado libre lo obtuvo por primera vez por el químico francés Henri Moissan el año 1886. Su denominación latina proviene del nombre del mineral fluorita; del latín 'flúor', de 'fluere', que significa fluir. Es un gas amarillo verdoso, irritante y extremadamente reactivo. Es el elemento más electronegativo y reactivo y forma compuestos con prácticamente todo el resto de elementos. Se utiliza en refrigerantes y otros fluorocarbonos. En la pasta dental como fluoruro de sodio (NaF) y fluoruro estañoso (SnF2); y también en Teflón.
| Densidad / g dm-3: | 1516 | (líquido, 85 K) |
| 1.696 | (gaseoso, 273 K) | |
| Volumen molar / cm3mol-1: | 12.53 | (líquido, 85 K) |
| 22403.78 | (gaseoso, 273 K) | |
| Resistencia eléctrica / µΩcm: | - | (20 °C) |
| Conductividad térmica / W m-1K-1: | 0.0256 |
| Punto de fusión / °C: | -219.62 |
| Punto de ebullición / °C: | -188.12 |
| Calor de fusión / kJ mol-1: | 1.02 |
| Calor de vaporización / kJ mol-1: | 3.26 |
| Calor de atomización / kJ mol-1: | 76.9 |
| Primera energía de ionización / kJ mol-1: | 1681.06 |
| Segunda energía de ionización / kJ mol-1: | 3374.20 |
| Tercera energía de ionización / kJ mol-1: | 6050.48 |
| en la atmósfera / ppm: | - |
| en la corteza terrestre / ppm: | 625 |
| en los océanos / ppm: | 1.3 |
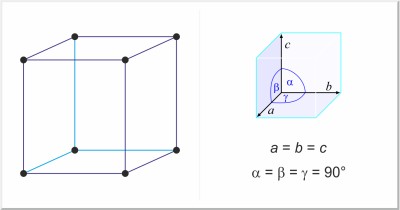
| Estructura cristalina: | cúbica simple |
| Dimensiones de la celda unidad / pm: | a=667 |
| Grupo espacial: | Pm3n |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 19F | 18.99840321(8) | 100 |
| Semirreacción | Eo / V | |
|---|---|---|
| F2(g) + 2e- → 2F- | +2.87 | |
| F2(g) + 2H+ + 2e- → 2HF | +2.81 | |
| F2(g) + 2H+ + 2e- → 2HF(aq) | +3.06 | |
| F2O + 4H+ + 4e- → 2HF + H2O | +2.12 | |
| F2O + 2H+ + 4e- → 2F- + H2O | +2.15 | |
| F2O + 2H+ + 2e- → F2(g) + H2O | +1.44 |
Citación de esta página:
Generalic, Eni. "Flúor." EniG. Tabla periódica de los elementos. KTF-Split, 8 Feb. 2026. Web. {Fecha de acceso}. <https://www.periodni.com/es/f.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
Copyright © 1998-2026 by Eni Generalic. Todos los derechos reservados. | Bibliografía | Disclaimer
