AZUFRE
ANFÍGENOS
| Número atómico: | 16 |
| Grupo: | 16 |
| Periodo: | 3 |
| Configuración electrónica: | [Ne] 3s2 3p4 |
| Estados de oxidación: | -2 +4 +6 |
| Electronegatividad: | 2.58 |
| Radio atómico / pm: | 103.5 |
| Masa atómica relativa: | [32.059, 32.076] |
El azufre se conoce desde tiempos prehistóricos y ya aparecía en la Biblia y en otros escritos antiguos. Su nombre procede del latín sulphur usado por los romanos para designarlo. Es sólido frágil, color amarillo pálido, inodoro e insípido. Existe en varias formas: rómbica, monoclínica y amorfa. Todas las formas de azufre son insolubles en agua. Está extendido amplia y abundantemente en la naturaleza, tanto en estado nativo, como combinado, formando sulfuros y sulfatos. Se utiliza para la fabricación de ácido sulfúrico, como insecticida en agricultura, en la industria del caucho. Interviene en la composición de la pólvora de caza, cerillas, bengalas luminosas.
| Densidad / g dm-3: | 2070 | (alfa, 293 K) |
| 1957 | (beta, 293 K) | |
| 1891 | (líquido, 393 K) | |
| Volumen molar / cm3mol-1: | 15.49 | (alfa, 293 K) |
| 16.38 | (beta, 293 K) | |
| 16.96 | (líquido, 393 K) | |
| Resistencia eléctrica / µΩcm: | 2E+23 | (20 °C) |
| Conductividad térmica / W m-1K-1: | 0.269 |
| Punto de fusión / °C: | 115.21 |
| Punto de ebullición / °C: | 444.60 |
| Calor de fusión / kJ mol-1: | 1.7175 |
| Calor de vaporización / kJ mol-1: | 9.62 |
| Calor de atomización / kJ mol-1: | 276.6 |
| Primera energía de ionización / kJ mol-1: | 999.60 |
| Segunda energía de ionización / kJ mol-1: | 2251.78 |
| Tercera energía de ionización / kJ mol-1: | 3356.75 |
| en la atmósfera / ppm: | 1 |
| en la corteza terrestre / ppm: | 260 |
| en los océanos / ppm: | 900 |
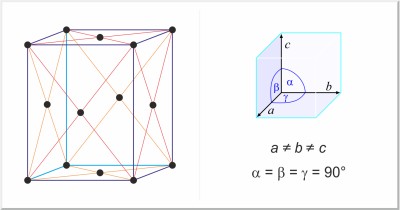
| Estructura cristalina: | ortorrómbica centrada en las caras |
| Dimensiones de la celda unidad / pm: | a=1046.46, b=1286.60, c=2448.60 |
| Grupo espacial: | Fddd |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 32S | 31.9720707(1) | 95.02(9) |
| 33S | 32.9714585(1) | 0.75(4) |
| 34S | 33.9678668(1) | 4.21(8) |
| 36S | 35.9670809(3) | 0.02(1) |
| Semirreacción | Eo / V | |
|---|---|---|
| S(s) + 2e- → S2- | - 0.476 | |
| S(s) + H+ + 2e- → HS- | - 0.065 | |
| S(s) + 2H+ + 2e- → H2S(g) | +0.141 | |
| SO42- + 4H+ + 2e- → H2SO3 + H2O | +0.172 | |
| SO42- + 4H2O + 2e- → SO3- + 2OH- | - 0.93 | |
| SO42- + 8H+ + 6e- → S(s) + 4H2O | +0.357 | |
| HSO4- + 7H+ + 6e- → S(s) + 4H2O | +0.339 | |
| SO42- + 8H+ + 8e- → S2- + 4H2O | +0.149 | |
| SO42- + 9H+ + 8e- → HS- + 4H2O | +0.252 | |
| SO42- + 10H+ + 8e- → H2S(g) + 4H2O | +0.303 | |
| HSO4- + 9H+ + 8e- → H2S(g) + 4H2O | +0.289 | |
| S2O82- + 2e- → 2SO42- | +2.01 | |
| S2O82- + 2H+ + 2e- → 2HSO4- | +2.123 | |
| S4O62- + 2e- → 2S2O32- | +0.08 | |
| S4O62- + 12H+ + 10e- → 4S(s) + 6H2O | +0.416 | |
| S2O62- + 2e- → 2SO32- | +0.026 | |
| SO2(g) + 4H+ + 4e- → S(s) + 2H2O | +0.451 | |
| H2SO3 + 4H+ + 4e- → S(s) + 3H2O | +0.450 | |
| 2SO32- + 6H+ + 4e- → S2O32- + 3H2O | +0.705 | |
| 2HSO3- + 4H+ + 4e- → S2O32- + 3H2O | +0.491 | |
| 4HSO3- + 8H+ + 6e- → S4O62- + 6H2O | +0.581 | |
| 4H2SO3 + 4H+ + 6e- → S4O62- + 6H2O | +0.509 | |
| SO32- + 6H+ + 6e- → S2- + 3H2O | +0.231 | |
| S22- + 2H+ + 2e- → 2HS- | +0.298 | |
| S22- + 2e- → 2S2- | - 0.524 | |
| S32- + 3H+ + 4e- → 3HS- | +0.097 | |
| S42- + 4H+ + 6e- → 4HS- | +0.033 | |
| S52- + 5H+ + 8e- → 5HS- | +0.003 |
| 15 Fósforo | ← | 16 Azufre | → | 17 Cloro |
Citación de esta página:
Generalic, Eni. "Azufre." EniG. Tabla periódica de los elementos. KTF-Split, 13 Feb. 2025. Web. {Fecha de acceso}. <https://www.periodni.com/es/s.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
