NITRÓGENO
GRUPO DEL NITRÓGENIO
| Número atómico: | 7 |
| Grupo: | 15 |
| Periodo: | 2 |
| Configuración electrónica: | [He] 2s2 2p3 |
| Estados de oxidación: | -3 -2 -1 +1 +2 +3 +4 +5 |
| Electronegatividad: | 3.04 |
| Radio atómico / pm: | 54.9 |
| Masa atómica relativa: | [14.006 43, 14.007 28] |
El nitrógeno fue aislado por el físico británico Daniel Rutherford en 1772 y reconocido en 1776 como gas elemental por el químico francés Antoine Laurent Lavoisier. La denominación latina Nitrogenium proviene de las palabras 'nitrón' = salitre y 'genus' = engendrador. Es un incoloro, inodoro, insípido, generalmente es un gas inerte. Representa alrededor del 78% de la atmósfera de la Tierra. La más importante aplicación comercial del nitrógeno es la obtención de amoniaco por el proceso de Haber. Sus combinaciones tienen una gran importancia como fertilizantes y como parte componente de los explosivos.
| Densidad / g dm-3: | 1026 | (21 K) |
| 880 | (m.p.) | |
| 1.2506 | (gaseoso, 273 K) | |
| Volumen molar / cm3mol-1: | 13.65 | (21 K) |
| 15.92 | (m.p.) | |
| 22399.97 | (gaseoso, 273 K) | |
| Resistencia eléctrica / µΩcm: | - | (20 °C) |
| Conductividad térmica / W m-1K-1: | 0.0258 |
| Punto de fusión / °C: | -210.00 |
| Punto de ebullición / °C: | -195.8 |
| Calor de fusión / kJ mol-1: | 0.72 |
| Calor de vaporización / kJ mol-1: | 5.577 |
| Calor de atomización / kJ mol-1: | 470.842 |
| Primera energía de ionización / kJ mol-1: | 1402.34 |
| Segunda energía de ionización / kJ mol-1: | 2856.11 |
| Tercera energía de ionización / kJ mol-1: | 4578.19 |
| en la atmósfera / ppm: | 780900 |
| en la corteza terrestre / ppm: | 20 |
| en los océanos / ppm: | 0.8 |
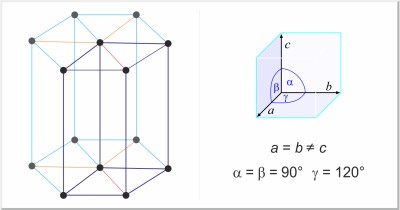
| Estructura cristalina: | hexagonal |
| Dimensiones de la celda unidad / pm: | a=404.2, c=660.1 |
| Grupo espacial: | P63/mmc |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 14N | 14.003074005(1) | 99.634(9) |
| 15N | 15.000108898(1) | 0.366(9) |
| Semirreacción | Eo / V | |
|---|---|---|
| N2(g) + 6H+ + 6e- → 2NH3(g) | +0.057 | |
| N2(g) + 2H2O + 6H+ + 6e- → 2NH×H2O | +0.092 | |
| N2(g) + 8H+ + 6e- → 2NH4+ | +0.275 | |
| N2(g) + 5H+ + 4e- → N2H5+ | - 0.23 | |
| NO3- + 2H+ + e- → NO2(g) + H2O | +0.775 | |
| 2NO3- + 4H+ + 2e- → N2O4(g) + 2H2O | +0.80 | |
| NO3- + 3H+ + 2e- → HNO2 + H2O | +0.94 | |
| NO3- + 3H+ + 2e- → HNO2 + H2O | +0.92 | (1 mol dm-3 HNO3) |
| NO3- + 2H+ + 2e- → NO2- + H2O | +0.835 | |
| NO3- + 4H+ + 3e- → NO(g) + H2O | +0.96 | |
| NO2(g) + e- → NO2- | +0.893 | |
| NO2(g) + H+ + e- → HNO2 | +1.093 | |
| NO2(g) + 2H+ + 2e- → NO(g) + H2O | +1.049 | |
| 2NO2(g) + 6H+ + 6e- → N2O(g) + 3H2O | +1.229 | |
| 2NO2(g) + 8H+ + 8e- → N2(g) + 4H2O | +1.363 | |
| NO2- + 2H+ + e- → NO(g) + H2O | +1.202 | |
| HNO2 + H+ + e- → NO(g) + H2O | +1.00 | |
| 2NO2- + 6H+ + 4e- → N2O(g) + 3H2O | +1.396 | |
| 2HNO2 + 4H+ + 4e- → N2O(g) + 3H2O | +1.297 | |
| 2NO2- + 8H+ + 6e- → N2(g) + 4H2O | +1.520 | |
| 2HNO2 + 6H+ + 6e- → N2(g) + 4H2O | +1.454 | |
| NO2- + 7H+ + 6e- → NH3(g) + 2H2O | +0.789 | |
| NO2- + 7H+ + 6e- → NH×H2O + H2O | +0.806 | |
| HNO2 + 7H+ + 6e- → NH4+ + 2H2O | +0.864 | |
| 2NO(g) + 2H+ + 2e- → N2O(g) + H2O | +1.591 | |
| 2NO(g) + 4H+ + 4e- → N2(g) + 2H2O | +1.678 | |
| NO(g) + 5H+ + 5e- → NH×H2O | +0.727 | |
| NO(g) + 6H+ + 5e- → NH4+ + H2O | +0.836 | |
| N2O(g) + 2H+ + 2e- → N2(g) + H2O | +1.766 | |
| N2O(g) + H2O + 8H+ + 8e- → 2NH×H2O | +0.510 | |
| N2O(g) + 10H+ + 8e- → 2NH4+ + H2O | +0.647 | |
| N3- + 7H2O + 6e- → N2H4 + NH3(g) + 7OH- | - 0.62 |
Citación de esta página:
Generalic, Eni. "Nitrógeno." EniG. Tabla periódica de los elementos. KTF-Split, 18 Jan. 2024. Web. {Fecha de acceso}. <https://www.periodni.com/es/n.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
